Last updated: 22 Aug 25 09:44:34 (Asia/Shanghai)
内分泌系统疾病
This tutorial is powered by Bensz/黄伟斌
速记
- 内分泌系统疾病的快速对比
| 疾病 | 关键线索 | 首选/确诊检查 | 首选治疗/处置 |
|---|---|---|---|
| 甲状腺功能亢进症 | 高代谢+心悸/手颤/体重减轻;Graves有浸润性突眼、胫前黏液性水肿;甲状腺血流亢进 | TSH↓、FT4/FT3↑;TRAb阳性支持Graves;放射性碘摄取(Graves弥漫增高,甲状腺炎低摄取) | 对症β受体阻滞;抗甲状腺药(首选甲硫咪唑);复发/不耐受可131I或手术;危象按流程救治 |
| 甲状腺功能减退症 | 畏寒乏力、便秘、体重增加、黏液性水肿;皮肤干燥、反应迟钝;桥本相关 | 原发:TSH↑、FT4↓;抗TPO抗体阳性;血脂↑、低钠 | 左甲状腺素替代(心血管病低剂量起始);妊娠需增量;昏迷:静脉甲状腺素+氢化可的松+保温补液 |
| 库欣综合征 | 向心性肥胖、满月脸、水牛背、紫纹;高血压、糖耐量异常、感染;药源性最常见 | 筛查三选一:1 mg地塞米松抑制试验、24h尿游离皮质醇、午夜唾液皮质醇;ACTH分型+影像/下岩窦采血 | 病因治疗:垂体腺瘤经蝶手术为首选;肾上腺肿瘤/异位源切除;必要时抑制皮质醇合成(酮康唑等) |
| 原发性醛固酮增多症 | 难治性高血压+低钾(也可钾正常);肌无力、麻痹,多尿 | 醛固酮/肾素比(ARR)升高筛查;盐负荷试验确诊;CT+肾上腺静脉采血分侧 | 单侧腺瘤腹腔镜切除;双侧增生螺内酯/依普利酮;术前补钾控压 |
| 肾上腺皮质功能减退 | 原发:皮肤/黏膜色素沉着、低钠高钾、低血压;继发:无色素沉着且多无高钾;危机可休克 | 8点皮质醇↓;ACTH原发↑/继发↓;短促同试验;肾素/醛固酮分型 | 维持:氢化可的松±氟氢可的松(原发需加盐皮质激素);危机:等渗盐水+葡萄糖+氢化可的松即刻 |
| 嗜铬细胞瘤 | 头痛+心悸+出汗三联征,阵发/持续性高血压,体位性低压,高血糖 | 血浆游离甲氧基肾上腺素或24h尿甲氧基儿茶酚胺↑;CT/MRI定位;MIBG/核素示踪 | 手术切除;术前α受体阻滞+补液后再加β阻滞;恶性/转移性行放化疗/靶向 |
| 糖尿病 | 多饮多尿多食消瘦或无症状体检发现;慢性并发症风险高 | 诊断:空腹血糖≥7.0或2h血糖≥11.1或随机≥11.1有症状;HbA1c≥6.5%(标准化实验室) | 生活方式+二甲双胍为首选;合并ASCVD/心衰/肾病优选GLP-1RA/SGLT2i;1型/失代偿需胰岛素 |
| 低血糖症 | Whipple三联征:低血糖症状+血糖低+纠正后缓解;多见于胰岛素/磺脲过量 | 发作时血糖、胰岛素、C肽、胰高血糖素、磺脲筛查;必要时72小时禁食试验 | 清醒口服糖;重症静脉葡萄糖;无静脉通路肌注胰高血糖素;查因:胰岛素瘤手术、药源性调整方案 |
- 甲亢病因快速鉴别
| 类型 | TRAb | 放射性碘摄取/超声血流 | 其他要点 |
|---|---|---|---|
| Graves病 | 阳性 | 弥漫增高;彩超血流“火海征” | 浸润性突眼、胫前黏液性水肿;甲状腺杂音 |
| 毒性多结节/腺瘤 | 阴性 | 斑片/孤立热点 | 老年常见;无突眼;触及结节 |
| 亚急性甲状腺炎 | 多阴性 | 低摄取;血流少 | 颈痛+ESR显著升高;自限,后期可短暂甲减 |
| 无痛性/产后甲状腺炎 | 可阳性(TPOAb) | 低摄取 | 产后数月内发作;短暂性甲亢→甲减→恢复 |
| hCG相关(妊娠/绒癌) | 阴性 | 摄取不定 | hCG极高;轻中度甲亢为主 |
- (超纲)甲状腺疾病对应的激素变化
| 指标/情景 | 主要实验学变化 | 临床意义 |
|---|---|---|
| 原发性甲亢(Graves等) | TSH↓,FT4↑(或T4↑),FT3↑(或T3↑,有时T3占优) | 抑制性TSH提示垂体受负反馈抑制,FT3升高可解释临床亢进表现(心悸、消瘦、震颤);T3占优型提示病情严重或早期/亚临床T4正常时的活动性甲亢。 |
| 原发性甲减 | TSH↑(显著升高),FT4↓(或T4↓) | TSH升高为甲状腺泵功能不足的指标,FT4下降与代谢减低、疲乏、体重增加等临床表现相关;长期轻度FT4低下可致高胆固醇等代谢异常。 |
| 亚临床甲亢 | TSH↓(低),FT4正常,FT3正常 | 提示轻度过高的甲功能或开始期甲亢;老年或心血管病人需警惕房颤与骨质疏松风险,决定是否治疗应综合风险与TSH下降程度。 |
| 亚临床甲减 | TSH↑(轻度升高,常在4.5–10 mIU/L),FT4正常 | 常见于早期甲减或自身免疫性甲炎携带者;孕妇、拟妊者或有心血管病者可考虑替代治疗;TSH持续>10 mIU/L常建议治疗。 |
| 中枢性(继发/三发性)甲减 | TSH正常或低/不恰当正常,FT4↓(或T4↓) | TSH-FT4不匹配提示垂体/下丘脑病变,需进一步检查垂体功能、影像学;不能用TSH单独排除甲减。 |
| 亚急性/痛性甲状腺炎(颈部痛) | 早期:TSH↓,FT4↑,FT3↑(破坏性释放);随后过渡到甲减期:TSH↑,FT4↓ | 过程性激素释放(破坏性甲状腺炎)导致短期甲亢伴疼痛,随后常出现短暂或持续甲减;病史与CRP/ESR升高帮助鉴别。 |
| 无痛性/亚临床甲状腺炎 | 类似破坏期:短暂TSH↓、FT4↑,随后可出现TSH↑ | 无明显颈痛但有甲功能波动,常与产后或自身免疫有关,需随访激素恢复情况。 |
| 甲状腺激素替代或抑制治疗(外源性) | 服用甲状腺素:TSH↓(剂量依赖),FT4/FT3可正常或升高;抑制治疗用于甲癌随访时低TSH | TSH用于评估替代剂量或抑制目标;外源性T3/T4可导致低TSH而FT4/FT3水平需结合服药史判断是否过量。 |
| 非甲状腺疾病综合征(Euthyroid sick) | 轻-重病程中常见:总T3↓(低T3综合征),FT3↓,FT4可正常或低,总T4可降低,TSH常正常或轻度下降/升高 | 多数为暂时性代谢改变,不等同甲减;在严重慢性病或重症患者中需谨慎,不应仅依据异常激素开始长期替代治疗,待病情稳定后复查。 |
| 甲状腺功能自抗体/自身免疫性甲炎(Hashimoto) | 早期或隐匿期可为亚临床甲减(TSH↑、FT4正常),晚期出现TSH↑、FT4↓ | 抗体(TPOAb、TgAb)阳性提示自身免疫病因;预测进展至明确甲减的风险,需随访TSH与临床症状。 |
| 甲状腺激素抵抗/检验干扰 | 激素抵抗:TSH正常或升高伴高FT4/FT3;检验伪异常(药物、结合蛋白异常、免疫测定干扰)可出现不相称的结果 | 若TSH与FT4/FT3矛盾且临床不符,应考虑垂体激素测定、结合蛋白(TBG)测定、稀释/不同平台复测或评估家族史以鉴别激素抵抗或实验室伪阳性。 |
| 妊娠相关改变 | 早孕:TSH可轻度下降(hCG作用),总T4↑(TBG增高),FT4通常在参考范围内或轻度变化 | 妊娠需使用妊娠特异参考范围;对已知甲病患者调整治疗以维持适当TSH以保护胎儿发育。 |
- 内分泌性高血压鉴别要点
| 疾病 | 电解质/代谢 | 关键实验 | 提示要点 |
|---|---|---|---|
| 原发性醛固酮增多症 | 低钾+碱中毒;低肾素 | ARR升高,盐负荷试验不抑制 | 难治高压、肌无力/麻痹;AVS分侧指导治疗 |
| 嗜铬细胞瘤 | 高血糖、乳酸可升 | 血浆游离甲氧基肾上腺素↑ | 头痛心悸出汗三联征;阵发/波动血压 |
| 库欣综合征 | 低钾碱中毒可见(异位ACTH) | 地塞米松抑制/尿游离皮质醇↑ | 向心性肥胖、紫纹、多发感染 |
| 甲亢相关高心排 | 电解质多正常 | TSH↓、FT4/FT3↑ | 心悸、手颤、体重下降、突眼/血流亢进 |
- 原发与继发肾上腺功能减退鉴别
| 要点 | 原发(Addison) | 继发/三发 | 危机处理要点 |
|---|---|---|---|
| 色素沉着 | 明显 | 无/轻 | 等渗盐水+5%葡萄糖快速复苏→氢化可的松100 mg静推后持续→纠正高钾/低糖→查因与治疗 |
| 钠/钾 | 低钠高钾 | 低钠常见,高钾少见 | |
| 血浆肾素/醛固酮 | 肾素↑、醛固酮↓ | 多正常 | |
| ACTH | 升高 | 降低 | |
| 治疗维持 | 氢化可的松+氟氢可的松 | 氢化可的松(多不需氟氢可的松) |
基础
甲状腺功能亢进症
病因
- 自身免疫:Graves病(弥漫性毒性甲状腺肿,最常见原因),TSH受体抗体(TRAb/TSI)介导。TRAb 包括3个亚型:甲状腺刺激性抗体(TSAb)、甲状腺阻断性抗体(TBAb)和甲状腺中性抗体。TSAb 是 Graves 病的致病抗体。
- 自主功能性病变:毒性多结节性甲状腺肿、毒性腺瘤。
- 破坏性甲状腺炎早期:亚急性甲状腺炎(痛性,ESR↑)、无痛性/产后甲状腺炎(无痛,低摄取)。
- 妊娠/绒癌:hCG介导性甲状腺毒症。
- 药物/外源:碘致甲亢(Jod-Basedow)、胺碘酮I型、外源性甲状腺素摄入。
发病机制
- Graves:TRAb激活TSH受体→甲状腺滤泡细胞增生与激素合成分泌↑;眼眶炎症+黏多糖沉积致浸润性突眼。
- 甲状腺炎:腺体破坏→预存激素“泄漏”型甲状腺毒症(合成并不增加)。
- T4(甲状腺素,thyroxine)是“储备”型、产量多、在体内经周围组织脱碘转为活性形式T3;T3(三碘甲状腺原氨酸)是“活性”型,对受体亲和力更高、生物学效应更强、但半衰期短、产量少。
三活四存
临床表现
- 全身高代谢:怕热、多汗、体重下降、乏力。
- 心血管:心悸、房颤、高输出性心衰。
- 神经精神:焦虑、易怒、手颤、失眠。
- 肌骨:近端肌无力、骨质疏松。
- 消化/内分泌:食欲亢进、腹泻、女性月经稀少。
- 体征:甲状腺肿大伴血流亢进杂音;Graves特有浸润性突眼、胫前黏液性水肿。
- 并发症:甲状腺危象(感染、手术、分娩、碘造影诱发)——高热、极度心动过速、意识障碍、心衰。
| 系统/部位 | 典型表现 | 简明要点 |
|---|---|---|
| 代谢/全身 | 多汗、不耐热、食欲增加、体重下降、乏力、耐糖异常 | 高代谢综合征:提示甲亢代谢亢进,应评估体重与血糖。 |
| 精神神经 | 易烦躁、易激动、失眠、多动、注意力不集中 | 常伴焦虑、情绪不稳;与交感神经过度兴奋相关。 |
| 心血管 | 持续性心悸、静息也难缓解;心率快,心律常为窦性或房性早搏,可出现房颤 | 高风险并发症:心房颤动、心力衰竭;必要时抗心律失常与抗凝。 |
| 消化 | 食欲增多、消瘦、肠蠕动加快、大便次数增多 | 注意营养支持与电解质监测。 |
| 肌肉骨骼 | 周期性瘫痪(TPP)表现为四肢瘫痪,以下肢为主,不能站立或行走,常伴低钾血症 | 以亚洲/拉丁美洲年轻男性多见;遇低钾应急速纠正并控制甲状腺功能。 |
| 造血 | 白细胞总数与中性粒细胞比例下降,淋巴细胞比例↑,红细胞数可↑,血小板通常正常 | 注意血常规改变,排除其他血液病。 |
| 生殖 | 女性月经稀少或闭经、周期延长;男性可见阳萎或乳腺发育 | 影响生育与月经,应评估生殖功能。 |
| 皮肤/毛发 | 皮肤因血管扩张与多汗而温暖、潮湿;可有色素脱失、斑秃或白斑 | 皮肤与毛发改变常并存,提示长期甲状腺功能异常。 |
| 眼部 | 眼球突出、上睑退缩、眼裂增宽、复视、视力下降(重者可致眼球固定) | 提示甲状腺相关眼病(GO),需眼科评估与影像学。 |
| 甲状腺危象 | 多见于未充分治疗或诱因(感染、创伤、精神刺激)后:高热、大汗、心悸、烦躁、呕吐、腹泻、意识障碍、心衰或休克 | 危及生命,立即住院、控制体温、补液、β阻滞、抗甲状腺药物与支持治疗。 |
| 淡漠型甲亢 | 多见老年,起病隐袭,表现为充血性心力衰竭样、心律失常或不明原因体重减轻,代谢症状不明显 | 易误诊为心脏病或恶性肿瘤,老年人甲状腺功能检查不可少。 |
| Graves(病特征) | 甲状腺肿:功能亢进时常为双侧弥漫性肿大、质中等、光滑、可有血管杂音;眼病(GO):眼突、疼痛、复视、视力下降;皮肤病变约5% | Graves特点:弥漫性甲状腺肿伴眼部异常(GO)为典型表现,皮肤黏液性水肿少见。确诊需结合免疫学(TRAb)与影像。 |
辅助检查
- 甲功:TSH显著下降(最敏感的指标),FT4/FT3升高;T3优效型时FT3升高更明显。
- 免疫:TRAb阳性支持Graves;TPOAb/TgAb多见阳性。
- 影像/功能:放射性碘摄取率(RAIU)及显像:Graves弥漫增高;毒性结节“热点”;甲状腺炎低摄取。甲状腺超声彩色多普勒示血流“火海征”。
- 其他:血脂偏低、轻度转氨酶升高;眼眶影像评估突眼。
| 项目 | 临床意义或特点 | 简明说明 |
|---|---|---|
| TSH | 血清TSH是反映甲状腺功能的最敏感指标 | 用于诊断亚临床与临床甲亢/甲减,常作为筛查甲状腺疾病的第一线试验;TSH降低提示甲功能亢进,升高提示功能减退。 |
| TT3、TT4 | 总甲状腺激素(结合型+游离型)受甲状腺激素结合球蛋白(TBG)影响 | 血中T3约20%由甲状腺直接分泌、80%由外周T4转换;TT3、TT4受TBG浓度变化影响,故在血浆蛋白异常时解释需谨慎。 |
| FT3、FT4 | 游离T3、T4不受TBG影响,能直接反映甲功能状态,为诊断甲亢的主要指标 | FT3仅占总T3约0.35%,FT4仅占总T4约0.025%;含量低但临床意义更直接、稳定性略逊于常规测定的TT3/TT4,常用于明确甲功能水平及治疗监测。 |
| TRAb(TSH受体抗体) | TRAb为诊断Graves病的一线指标 | 未治疗的Graves病TRAb阳性率约80%–100%;TRAb阳性反映体内存在针对TSH受体的抗体,提示自身免疫性甲亢,但阳性并不等同于抗体功能性描述(刺激性/阻断性需进一步检测)。 |
| TSAb(甲状腺刺激抗体) | 为诊断Graves病的重要免疫学指标 | 新发Graves病患者TSAb阳性率约85%–100%,阳性提示存在刺激性抗体,常与临床甲亢对应。 |
| 131I摄取率 | 反映甲状腺对放射性碘的摄取能力,已被sTSH测定部分取代 | 正常参考值:3小时约5%–25%,24小时约20%–45%;高摄取提示甲亢(如Graves病或结节性甲亢),低摄取见于甲状腺炎或外源性甲状腺激素摄入(摄取率↓)。24小时峰值常用于鉴别甲亢病因。 |
| 核素扫描 | 甲状腺放射性核素扫描对诊断甲状腺功能性结节/腺瘤有意义 | 用于评估结节活动性(“hot”功能亢、“cold”功能低或无功能),有助于鉴别甲亢病因与结节性质,并指导治疗选择。 |
诊断和鉴别诊断
-
诊断:甲亢症状+TSH↓/FT4或FT3↑;结合TRAb与RAIU分型。
-
鉴别:甲状腺炎(颈痛、ESR↑、低摄取)、焦虑症、嗜铬细胞瘤、药源性甲状腺毒症、妊娠相关hCG升高。
相关药物
- 常用抗甲状腺药物(ATD):
孕妇不宜用咪咪;甲方给钱慢吞吞,丙方干活速度快
| 项目 | 丙硫氧嘧啶 (PTU) | 甲硫咪唑 (MMI) / 卡比马唑 (carbimazole) |
|---|---|---|
| 常用药 | 丙硫氧嘧啶(PTU) | 甲硫咪唑(MMI),卡比马唑为MMI前体 |
| 特点 | 半衰期短(约1.5小时),需每6–8小时给药一次;起效较快。 | 半衰期较长(约6小时),每日一次给药通常足够;起效相对较慢但给药方便。 |
| 作用 | 主要抑制甲状腺激素合成,并能抑制外周组织中T4向T3的转换(因此起效较快)。 | 抑制甲状腺激素合成,但不明显抑制T4向T3的外周转换;控制甲亢较稳健、起效较慢。 |
| 副作用 / 临床选择 | 肝毒性风险较高,可出现严重肝损伤;因此通常非首选,但在妊娠早期因致畸风险较低且起效快,仍可作为首选药物。美国FDA将PTU推荐为二线(成人非孕)药物。 | 致畸风险相对更高(妊娠早期慎用),但肝毒性总体较少;作为常规首选药物用于大多数甲亢患者。妊娠时后期(妊娠中晚期)优先使用MMI以减少母体肝损伤风险。 |
- ATD的常见不良反应
| 项目 | 粒细胞减少症 | 皮疹 | 中毒性肝病 / 血管炎 |
|---|---|---|---|
| 发生率 | 约为 5% | 约为 5% | 中毒性肝病:0.1%–0.2%;血管炎:少见 |
| 发生时间/情境 | 多在用药后 2–3个月内发生 | 时间不定 | PTU:以肝细胞损害为主;MMI:以胆汁淤积为主;血管炎随用药时间延长发生率增加 |
| 特点 | 两类抗甲状腺药(ATD)可有交叉反应,故不能换药继续使用;严重者需停药并处理 | 轻者可换用另一种ATD,重者停药 | PTU肝损害较MMI严重且常见;血管炎与抗中性粒细胞胞质抗体(ANCA)相关 |
| 主要区别/定位 | 以甲亢所致中性粒细胞减少为主 | —— | 以肝功能异常或血管炎表现为主,区分PTU与MMI所致类型 |
| 处理措施 | 给与升白细胞治疗;当中性粒细胞 <1.5×10^9/L 时应停药并处理 | 轻度可予抗组胺药或短期激素,重度停药并给予相应支持治疗 | 监测肝功能;首选MMI(对轻度肝损伤);若为PTU所致严重肝损害,停药并根据病情选择保守或手术/移植等治疗;血管炎按症状及免疫学处理 |
治疗
- 对症:β受体阻滞剂(普萘洛尔)缓解心悸震颤。
- 抗甲状腺药(ATD):甲硫咪唑为首选(非孕);妊娠早期首选丙硫氧嘧啶,中晚期可改甲硫咪唑;不良反应:粒细胞缺乏、肝毒性(PTU警惕)。ATD 治疗是甲亢的基础治疗,但治愈率仅约50%,复发率高达40%~60%。
- 131I:成人复发/药物不耐受/拒绝手术者;重突眼慎用。
- 手术:巨大甲状腺肿压迫、怀疑恶性、妊娠药物控制差、复发。
- 危象:大剂量PTU(或MMI)→1小时后碘剂(卢戈碘液)→β阻滞→糖皮质激素→补液、降温、纠正电解质与诱因。
- 其它治疗
| 疾病/情况 | 分型/分期 | 治疗要点 |
|---|---|---|
| Graves眼病 | 一般治疗 | 戒烟、控制高胆固醇血症;选择合适的甲亢治疗方法;眼局部对症治疗(有色眼镜、人工泪液、眼罩保护角膜) |
| 轻度活动期 | 控制危险因素前提下随访观察,或给予6个月补硒治疗 | |
| 轻度稳定期 | 观察,必要时眼部康复手术 | |
| 中重度活动期 | 越早治疗效果越好:糖皮质激素、靶向免疫抑制剂、眼眶放射治疗、眼眶减压手术 | |
| 妊娠期甲亢 | 抗甲状腺药物 | 首选丙硫氧嘧啶(蛋白结合后不易通过胎盘) |
| 哺乳期甲亢 | 抗甲状腺药物 | 丙硫氧嘧啶和甲巯咪唑均可选择 |
| 甲亢性心脏病 | 诊断标准 | 甲亢反复复发、未规则治疗者(尤其结节性甲状腺肿伴甲亢);有心律失常(70%为房颤)、心脏扩大、心力衰竭、心绞痛、心肌梗死、二尖瓣脱垂之一,排除其他心脏病 |
| 抗甲状腺药物 | 立即给予足量抗甲药,控制甲状腺功能至正常 | |
| ¹³¹I治疗 | 抗甲药控制症状后,尽早给予大剂量¹³¹I破坏甲状腺组织 | |
| 房颤处理 | 普萘洛尔、洋地黄控制;控制甲亢后可电复律 | |
| 甲亢合并周期性瘫痪 | 临床特点 | 好发于男性青壮年;双侧对称性肌无力起病,活动后加重,伴肌痛,双下肢容易受累;劳累、进食富含碳水化合物食物、应用胰岛素可诱发;发作时血钾降低,尿钾正常 |
| 补钾治疗 | 轻症口服补钾;严重者静脉滴注氯化钾,好转后改口服钾盐 | |
| 辅助呼吸 | 出现呼吸肌瘫痪时采用辅助呼吸 | |
| 根除性治疗 | 甲亢控制后周期性瘫痪消失,可选用手术或¹³¹I根除性治疗 |
甲状腺功能减退症
病因
- 桥本甲状腺炎(原发性,最常见);甲状腺手术/131I后;药物(胺碘酮、锂、过量碘);先天性甲状腺发育不全/合成酶缺陷;甲状腺炎恢复期。
- 继发/中枢性:垂体/下丘脑病变、放疗/手术后、Sheehan综合征等。
发病机制
甲状腺激素缺乏→基础代谢率下降;黏多糖沉积致“黏液性水肿”。
临床表现
畏寒、乏力、嗜睡、记忆力减退、反应迟钝、皮肤干燥粗厚、面色晦暗、非凹性水肿、体重增加、便秘、月经失调/不孕、心动过缓、心包/胸腔积液、高脂血症;腱反射松弛期延长。重者黏液性水肿昏迷(寒冷/感染/镇静药诱发)。
| 系统/分类 | 临床表现 |
|---|---|
| 一般表现 | 代谢率降低、交感神经兴奋性下降:畏寒、易疲劳、怕冷、体重增加、嗜睡、记忆力减退 |
| 消化系统 | 厌食、腹胀、麻痹性肠梗阻、黏液水肿性巨结肠 |
| 心血管系统 | 心肌收缩力降低、心率减慢、心排血量下降,心电图显示低电压 |
| 内分泌系统 | 月经紊乱、不孕 |
| 造血系统 | 血红蛋白合成障碍,肠道吸收铁障碍引起铁缺乏,叶酸缺乏,恶性贫血 |
| 骨骼肌系统 | 肌无力,肌进行性萎缩 |
| 生殖系统 | 女性:月经周期紊乱、月经量过多、不孕、溢乳;男性:性欲减退、阳痿和精子减少 |
| 体征 | 表情呆滞、反应迟钝、声音嘶哑、听力障碍、面色苍白、黏液性水肿,皮肤干燥发凉、粗糙脱屑 |
| 黏液性水肿昏迷 | 甲减严重状态,易在寒冷时发病,表现为低体温、嗜睡、心动过缓、血压降低、肌肉松弛 |
辅助检查
- 甲功:原发TSH↑、FT4↓;中枢性TSH不高或↓、FT4↓;亚临床TSH↑、FT4正常。
- 抗体:抗TPOAb阳性常见。
- 其他:血脂↑、低钠、轻度贫血;心电低电压。
诊断和鉴别诊断
- 诊断:症状+甲功分型;排除药物/中枢性因素。
| 检查项目 | 临床意义 |
|---|---|
| TSH、TT₄和FT₄ | 血清TSH是评估甲状腺功能最敏感指标,TT₄或FT₄降低是诊断甲减的必备指标;原发性甲减:TSH升高先于T₄的降低;中枢性甲减:TSH降低或正常,T₄、FT₄降低;亚临床甲减:TSH升高,TT₄、FT₄正常 |
| TRH兴奋试验 | 用于甲减病因的鉴别。静脉注射TRH后:TSH不升高→垂体性甲减;延迟升高→下丘脑性甲减;基础TSH升高,TRH刺激后TSH升高更明显→原发性甲减 |
| 甲状腺自身抗体 | 血清甲状腺过氧化物酶抗体(TPOAb)或甲状腺球蛋白抗体(TgAb)阳性,提示甲减是由自身免疫性甲状腺炎所致 |
| ¹³¹I摄取率 | 为避免¹³¹I对甲状腺的进一步损害,一般不做此检查 |
- 鉴别:抑郁、肥胖、肾病综合征、黏液性水肿与心肾性水肿。
治疗
- 维持:左甲状腺素钠清晨空腹服用;年轻无心病可按体重满量起始(约1.6 μg/kg/d),老年/冠心病小剂量起始渐增;妊娠需提高剂量,目标TSH孕早<2.5。
- 急救(黏液性水肿昏迷):保温、静脉左甲状腺素±三碘甲状腺原氨酸、氢化可的松(未排除并发肾上腺不全前)、纠正低钠与通气。
| 治疗类别 | 治疗要点 |
|---|---|
| 甲状腺激素替代治疗 | 首选左甲状腺素(L-T₄)单药治疗,需要终身服药。治疗目标:将血清TSH和甲状腺激素水平恢复到正常范围。补充甲状腺激素重新建立下丘脑-垂体-甲状腺轴平衡需要4-6周;治疗初期每4-6周测定激素指标;TSH和T₄达标后6-12个月复查1次。中枢性甲减患者要依据FT₄水平而非TSH调整剂量 |
| 一般治疗 | 有贫血者可补充铁剂、维生素B₁₂或叶酸;缺碘者应食用加碘盐或补充碘剂 |
| 黏液性水肿昏迷治疗 | 补充甲状腺激素:首选L-T₃静脉注射,或L-T₄静脉注射,清醒后改为口服 |
| 支持治疗:保温、吸氧、保持呼吸道通畅,必要时行气管切开、机械通气 | |
| 激素治疗:氢化可的松持续静滴 | |
| 液体管理:根据需要补液,但入水量不宜过多 | |
| 综合治疗:控制感染,治疗原发病 |
库欣综合征(Cushing)
病因
- 外源性糖皮质激素应用为最常见。
- 内源性:ACTH依赖(垂体腺瘤=库欣病、异位ACTH/CRH肿瘤),ACTH非依赖(肾上腺腺瘤/癌/结节性增生)。

发病机制
皮质醇过多→蛋白分解、糖异生增加、脂肪重分布、矿皮样作用增强。
临床表现
向心性肥胖、满月脸、水牛背、紫纹(>1 cm、紫红)、皮肤脆弱瘀斑、近端肌无力、骨质疏松/骨折、高血压、糖耐量异常/糖尿病、低钾代谢性碱中毒(异位ACTH多见)、感染、精神症状、女性月经紊乱/多毛。
- 库欣綜合征分类
| 类型 | 临床表现 | 特点 | 备注 |
|---|---|---|---|
| 典型病例 | 向心性肥胖,满月脸,多血质,紫纹 | 经典的库欣综合征表现 | 库欣病、肾上腺腺瘤、异位ACTH综合征的缓进型 |
| 重型早期病例 | 体重减轻,高血压,水肿,低钾性碱中毒 | 病情严重,进展迅速,摄食减少 | 需要及时诊断和治疗 |
| 并发症为主 | 以高血压为主,均匀肥胖,向心性肥胖不典型 | 全身情况好,尿游离皮质醇明显增高 | 容易漏诊,需要高度警惕 |
| 周期性发作 | 心衰、脑卒中、病理性骨折、精神症状、肺部感染 | 年龄大,库欣综合征易被忽略 | 机制不清,病因不明;部分病例可能为垂体性、异位ACTH性 |
- 典型库欣综合征的临床表现
| 系统/表现 | 临床症状 | 发生机制 |
|---|---|---|
| 向心性肥胖、满月脸 | 典型的体型改变 | 糖皮质激素导致的脂肪重新分布 |
| 多血质外貌 | 面部潮红,血色丰满 | 皮肤菲薄、微血管易透见、红细胞和血红蛋白增多(皮质醇刺激骨髓) |
| 全身肌肉系统 | 肌无力,下蹲后起立困难 | 糖皮质激素对肌肉的分解代谢作用 |
| 神经系统 | 常有不同程度的精神、情绪变化,如情绪不稳、烦躁、失眠,严重者精神变态 | 皮质醇对中枢神经系统的影响 |
| 皮肤表现 | 轻微损伤即可引起瘀斑。下腹两侧、大腿外侧出现紫纹,皮肤色素沉着加深 | 皮肤菲薄,胶原纤维减少,毛细血管脆性增加 |
| 心血管表现 | 高血压常见,动脉硬化、肾小动脉硬化、动静脉血栓、心血管并发症发生率增加 | 糖皮质激素的盐皮质激素样作用 |
| 抗感染能力减弱 | 长期皮质醇分泌过多使免疫力减弱,肺部感染多见;化脓性细菌感染不容易局限化 | 糖皮质激素的免疫抑制作用 |
| 性功能障碍 | 女性:月经减少,痤疮,明显男性化(见于肾上腺皮质癌);男性:性欲减退,阴茎缩小,睾丸变软 | 肾上腺雄激素产生过多、大量皮质醇抑制垂体促性腺激素 |
| 代谢障碍 | 类固醇性糖尿病、低钾性碱中毒(见于肾上腺皮质癌、异位ACTH综合征) | 糖皮质激素影响糖代谢和电解质平衡 |
辅助检查
- 筛查(任选其一,阳性重复确认):1 mg地塞米松抑制试验(夜服,次晨皮质醇不受抑)、24小时尿游离皮质醇↑、午夜唾液皮质醇↑。
- 分型:血浆ACTH(高/正=ACTH依赖,低=非依赖);高剂量地塞米松抑制试验、CRH兴奋试验;影像(垂体MRI、肾上腺CT);必要时下岩窦采血定位。
- 排除伪库欣:酒精依赖、重度抑郁、肥胖等。
诊断和鉴别诊断
满足筛查阳性并排除伪库欣后,行分型与定位。鉴别单纯肥胖、代谢综合征。
①小剂量地塞米松抑制试验对排除或诊断库欣综合征有重要价值——定性诊断。
②大剂量地塞米松柳制试验对确诊 Cushing病(鉴别库欣综合征病因)有重要价值—定位诊断。
③“小”剂量地塞米松抑制试验主要用于库欣综合征的定“性”诊断——记忆:
耍“小”“性”子。④“大”剂量地塞米松抑制试验主要用于库欣综合征的定“位"诊断——记忆为
“大”“卫”(大位)。
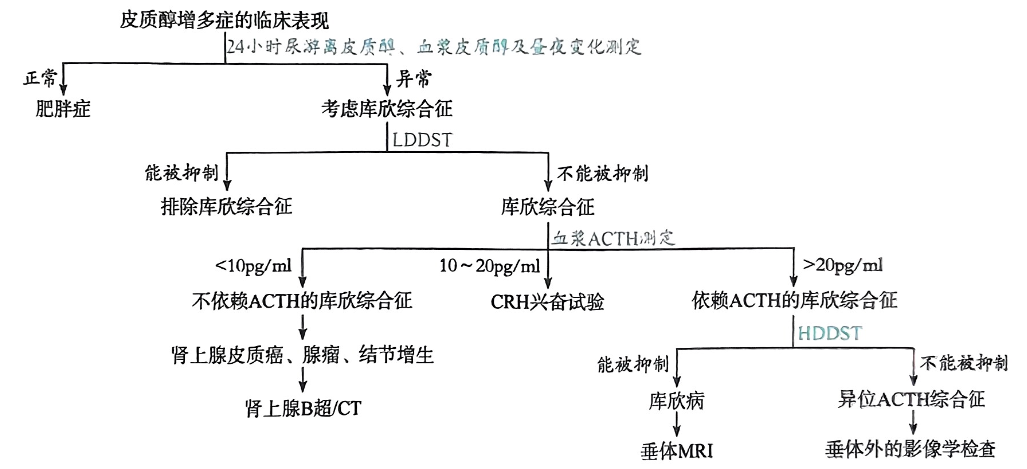
| 检查类型 | 检查项目 | 临床意义 |
|---|---|---|
| 筛查试验 | 血浆皮质醇昼夜节律 | 正常:早8时最高(276±66)nmol/L,下午4时(129.6±52.4)nmol/L,夜12时最低(96.5±33.1)nmol/L;库欣综合征:失去昼夜分泌节律 |
| 24小时尿游离皮质醇(UFC) | 正常:(130~304)nmol/24h;诊断敏感性及特异性较高,库欣综合征明显升高 | |
| 确诊试验 | 小剂量地塞米松抑制试验(LDDST) | 地塞米松0.5mg每6小时×2天;正常人:尿17-羟皮质类固醇抑制至50%以下,UFC抑制在55nmol/24h以下;库欣综合征:不能被抑制 |
| 病因诊断 | 血浆ACTH测定 | 肾上腺肿瘤:ACTH降低;库欣病:ACTH升高;异位ACTH综合征:ACTH更高 |
| 大剂量地塞米松抑制试验(HDDST) | 地塞米松2mg每6小时×2天;垂体性库欣综合征(库欣病):皮质醇被抑制50%以上;非垂体性:90%不能被抑制 | |
| CRH兴奋试验 | 库欣病:ACTH基础值高,CRH后升高>50%;肾上腺腺瘤:ACTH基础值低,升高<50%;异位ACTH:ACTH基础值高且不受CRH影响 | |
| 定位诊断 | 影像学检查 | 肾上腺病变:CT检查较敏感;垂体病变:MRI检查为佳 |
治疗
- 垂体腺瘤:经蝶垂体手术为首选;复发/残留放疗或药物。
- 肾上腺肿瘤:肾上腺切除;肾上腺癌可加米托坦。
- 异位ACTH:原发灶切除。
- 不能手术/过渡期:抑制皮质醇合成(酮康唑、甲吡酮、依托咪酯)、受体拮抗(米非司酮)。
- 双侧肾上腺切除后需终身糖/盐皮质激素替代,警惕Nelson综合征。

原发性醛固酮增多症
病因
- 醛固酮瘤(单侧腺瘤)与双侧特发性增生最常见;少数家族性高醛综合征。
| 类型 | 发病率 | 特点 |
|---|---|---|
| 醛固酮瘤 (Conn综合征) | 最常见 | 多为一侧腺瘤,直径1-2cm;病人血浆醛固酮浓度和血浆ACTH的昼夜节律平行,而对血浆肾素的变化无明显反应 |
| 特发性醛固酮增多症 (特醛症) | 多见 | 双侧肾上腺球状带增生,有时伴结节 |
| 糖皮质激素可治性醛固酮增多症 | 较少见 | 青少年起病,可家族性,以常染色体显性方式遗传 |
| 醛固酮癌 | 少见 | 为分泌大量醛固酮的肾上腺皮质癌 |
| 异位醛固酮分泌性腺瘤或腺癌 | 极罕见 | 可发生于肾内的肾上腺残余组织或卵巢内 |
发病机制
醛固酮过多→远曲小管/集合管Na水潴留、K/H排泄↑→容量负荷↑、低钾+代谢性碱中毒。
临床表现
难治性/发作性高血压,头痛,低钾致肌无力/周期性麻痹,多尿多饮,多汗,部分患者血钾可正常。
| 症状类别 | 主要表现 | 发生机制 |
|---|---|---|
| 高血压 | 最常出现的症状 | 保Na⁺保水导致的钠水潴留 |
| 低血钾 | 血钾降低 | 醛固酮过多导致肾脏排钾增加 |
| 神经肌肉功能障碍 | 肌无力、周期性瘫痪、肢端麻木,手足搐搦 | 低血钾导致的神经肌肉兴奋性改变 |
| 心脏表现 | 心电图呈低血钾图形,心律失常(阵发性室上速、室颤) | 低血钾影响心肌细胞电生理活动 |
| 肾脏表现 | 多饮,多尿,蛋白尿,尿路感染 | 慢性失钾致肾小管上皮变性 |
| 其他表现 | 儿童:生长发育障碍 成人:糖耐量减低 | 儿童:长期电解质紊乱影响发育 成人:缺钾时胰岛素分泌减少,作用减弱 |
辅助检查
- 筛查:清晨坐位血浆醛固酮↑、肾素抑制→ARR升高(注意停用干扰药物)。
- 确诊:盐负荷抑制试验(生理盐水/口服盐)、卡托普利试验、氟氢可的松试验。
- 定位与分侧:肾上腺CT;肾上腺静脉采血(AVS)为分侧金标准。
| 检查项目 | 检查结果 | 临床意义 |
|---|---|---|
| 低血钾 | 血钾一般在2-3mmol/L,严重者更低 | 醛固酮过多导致肾脏大量失钾 |
| 高尿钾 | 即使血钾很低,但尿钾仍>25mmol/24h | 反映肾脏持续性失钾,是诊断的重要指标 |
| 高血钠 | 血钠一般在正常高限,或略高于正常 | 醛固酮促进肾脏保钠作用 |
| 碱血症 | 血pH和CO₂CP为正常高限,或略高于正常 | 低血钾性碱中毒 |
| 尿pH | 为中性或偏碱性 | 反映体内酸碱平衡状态 |
| 尿比重固定 | 多在1.010-1.018,少数病人呈低渗尿 | 慢性失钾导致肾小管浓缩功能障碍 |
| 醛固酮 | 血浆及尿醛固酮均增高 | 原发性醛固酮增多症的直接证据 |
| 血浆肾素 | 血浆肾素降低 | 醛固酮过多抑制肾素-血管紧张素系统 |
| 血浆血管紧张素II | 血浆血管紧张素II(ATII)降低 | 反馈性抑制,有助于鉴别原发性和继发性醛固酮增多症 |
诊断和鉴别诊断
与原发性高血压、肾血管性高血压、库欣、嗜铬细胞瘤、利尿剂致低钾等鉴别。
| 诊断类型 | 检查项目 | 诊断标准与临床意义 |
|---|---|---|
| 筛查试验 | 血浆醛固酮/血浆肾素活性比值(ARR) | 最佳筛查试验;ARR>30为原醛症可能;≥50具有诊断意义 |
| 血醛固酮水平 | 原醛症患者血醛固酮通常>15ng/dl | |
| 确诊试验 | 生理盐水负荷试验 | 适用于:ARR超过切点值,血醛固酮仅轻度升高或在正常范围,不伴低血钾的高血压患者;方法:静卧位下4小时内静脉滴注2000ml生理盐水;结果:正常人血醛固酮抑制到5ng/dl以下,原醛症患者则在10ng/dl以上 |
| 病因鉴别 | 肾上腺B型超声 | 对直径>1.3cm的醛固酮瘤可显示出来,小腺瘤则难以和特发性增生相鉴别 |
| 高分辨率CT | 可检出直径小至5mm的肿瘤,但较小的肿瘤完全被正常组织包围时,检出较困难 | |
| MRI | 也可用于醛固酮瘤的定位诊断;对醛固酮瘤检出的灵敏度较CT高,但特异度较CT低 |
治疗
- 单侧腺瘤:腹腔镜肾上腺切除,术前纠正低钾与血压。
- 双侧增生/不能手术:螺内酯或依普利酮,低盐饮食,控压。
- 随访电解质与血压,评估心肾靶器官保护。
| 药物类别 | 主要适应证 | 作用机制/特点 |
|---|---|---|
| 螺内酯 | 特发性增生型原醛症首选 | 可使一部分原醛症病人醛固酮分泌减少,血钾和血压恢复正常 |
| 钙拮抗剂 | 原醛症的辅助治疗 | 醛固酮的合成需钙离子参与,阻断钙通道可干扰醛固酮合成 |
| ACEI | 原醛症病人血压控制 | 血管紧张素转换酶抑制剂,对原醛症病人可以奏效 |
| 糖皮质激素 | 糖皮质激素可治性醛固酮增多症(GRA) | 特异性治疗GRA,可有效抑制异常的醛固酮分泌 |
| 化疗药物 | 不能手术的醛固酮癌 | 醛固酮癌预后不良,发现时大多已失去手术根治机会,可行化学治疗 |
肾上腺皮质功能减退
病因
- 原发(Addison病):自身免疫最常见;结核/浸润/出血;遗传性酶缺陷;药物抑制。
- 继发/三发:垂体ACTH缺乏、下丘脑CRH不足;长期大剂量糖皮质激素骤停。
发病机制
糖皮质激素±盐皮质激素缺乏→低糖、低钠、高钾、低血压;RAAS代偿(原发时肾素↑)。
临床表现
- 原发:皮肤/黏膜弥漫性色素沉着、乏力消瘦、低血压、眩晕、纳差、低钠高钾、渴盐。
- 继发:无色素沉着,因肾素-醛固酮轴保留,高钾少见。
- 危机:剧吐腹痛、脱水、休克、低钠高钾低糖,常由感染/应激诱发。
| 项目 | 病理生理 | 临床表现 |
|---|---|---|
| ACTH ↑ | 促黑素(MSH)伴随升高,常见于原发性肾上腺皮质功能不全(Addison)。 | 典型体征 — 全身/黏膜色素沉着(可见于牙龈、舌部、颊黏膜等);伴乏力、体重下降。 |
| 醛固酮 ↓ | 矿物质皮质激素不足 → 保钠减弱、排钾减少。 | 低血钠、血容量减少 → 低血压、直立性头晕/晕厥;高血钾 → 心律失常及各系统功能减退(包括消化道与中枢神经系统表现如乏力、恶心、精神改变)。 |
| 皮质醇 ↓ | 糖代谢和应激反应受损(糖异生减少、糖原耗竭);抗炎、应激激素不足。 | 低血糖(尤其应激或空腹时)、乏力、耐受力下降;抗感染能力降低,感染易加重或表现不典型。 |
| 血液学改变 | 糖皮质激素不足对外周白细胞分布和造血有影响。 | 可见正细胞正色素性贫血;白细胞分布改变:中性粒细胞减少、淋巴细胞及嗜酸性粒细胞相对增多(可出现嗜酸性粒细胞↑)。 |
| 性激素 ↓ | 性激素(肾上腺源)分泌减少,伴内分泌失调。 | 女性:月经失调或闭经;男性:性欲减退、性功能下降;合并症状可为疲乏、体重减轻。 |
辅助检查
- 8点皮质醇↓;ACTH:原发↑、继发↓;短促同试验反应差。
- 电解质:低钠±高钾;肾素/醛固酮:原发肾素↑、醛固酮↓。
- 自身抗体(21-羟化酶Ab)、结核评估、影像学按需。
诊断和鉴别诊断
区分原发与继发;与慢性胃肠病、低血容量、甲减低钠、药物(ACEI/ARB/利尿剂)等鉴别。
| 检查项目 | 检查结果 | 临床意义 |
|---|---|---|
| 血浆总皮质醇 | 明显降低 | 反映肾上腺皮质分泌功能减退 |
| 24小时尿游离皮质醇(UFC) | 明显降低 | 反映体内皮质醇的总体水平,更准确评估皮质醇分泌状况 |
| 血浆ACTH | 明显升高,常较正常人高5-50倍 | 原发性肾上腺皮质功能减退的重要指标,反映下丘脑-垂体反馈调节 |
| ACTH兴奋试验 | 使用ACTH后,血、尿皮质醇不升高 | 最具有诊断价值,提示肾上腺皮质储备功能低下 |
| B超、CT检查 | 肾上腺结核:钙化灶、肾上腺增大等征象 | 有助于明确病因,特别是结核性肾上腺炎的诊断 |
| 抗肾上腺抗体 | 阳性 | 有助于自身免疫性肾上腺炎的诊断 |
治疗
- 维持:氢化可的松分次口服(或等效制剂)+原发时加氟氢可的松;教育“应激加量”。
- 危机:立刻等渗盐水+5%葡萄糖快速补液,氢化可的松100 mg静推后持续,纠正高钾与诱因;血压不稳可加缩血管药(液体复苏优先)。
| 治疗类型 | 治疗方法 | 具体要求与注意事项 |
|---|---|---|
| 糖皮质激素替代治疗 | 需终身治疗,首选氢化可的松 | 有发热等并发症时应适当加量 |
| 食盐补充 | 食盐的摄入量应充分,每日至少8-10g | |
| 盐皮质激素 | 氟氢可的松 | 头晕、乏力、血压偏低者,需加服氟氢可的松 |
| 病因治疗 | 抗结核治疗 | 活动性结核者,应行抗结核治疗 |
| 肾上腺危象 | 临床表现 | 为Addison病的严重表现;常发生于感染、创伤、手术、分娩、过劳、大量出汗、呕吐、腹泻、失水或突然中断肾上腺皮质激素治疗等应激情况;表现为恶心、呕吐、腹痛或腹泻、严重脱水、血压降低、心率快、脉细弱、精神失常,常有高热、低血糖症、低钠血症、血钾可低可高 |
| 急救措施 | ①补充液体,第1、2日补充生理盐水2000-3000ml;②补充葡萄糖以避免血糖过低;③糖皮质激素的应用;④积极治疗感染及其他诱因 |
嗜铬细胞瘤
病因
来源于肾上腺髓质或交感副神经节的儿茶酚胺分泌肿瘤;可与遗传综合征相关(MEN2、VHL、NF1 等)。
发病机制
去甲肾上腺素/肾上腺素过量→血管收缩、心率增快、代谢改变。
临床表现
头痛+心悸+出汗三联征,阵发或持续性高血压,苍白/惊恐感,体位性低血压,糖耐量异常/高血糖,发作可由用力、体位、手术、压力、某些药物诱发。
| 系统 | 临床表现 | 病理机制 |
|---|---|---|
| 心血管系统 | 血压不稳定(可升高、降低或正常)、心率加快、心缩力增强、心律失常 | 儿茶酚胺过度分泌导致 |
| 高血压为最主要症状 | ||
| 阵发性高血压(特征性表现) | ||
| 持续性高血压(最常见);低血压、休克;心律失常 | ||
| 基础代谢 | 基础代谢率增高,耗氧量增加,代谢亢进 | 儿茶酚胺促进代谢 |
| 可引起发热、消瘦 | ||
| 物质代谢 | 血糖升高,糖耐量降低 | 肝糖原分解加速,胰岛素分泌减少,肝糖异生加强 |
| 脂肪分解加速 | 游离脂肪酸浓度增高 | |
| 蛋白质分解增加 | 导致消瘦 | |
| 电解质 | 低钾 | 与儿茶酚胺促使K⁺进入细胞内,促进肾素、醛固酮分泌有关 |
| 高钙 | 与肿瘤分泌甲状旁腺激素相关蛋白有关 | |
| 消化系统 | 便秘、肠扩张 | 肠蠕动减慢、张力减弱 |
| 肠出血、穿孔、坏死 | 儿茶酚胺使胃肠壁内血管发生增殖性及闭塞性动脉内膜炎 | |
| 胆结石 | 与儿茶酚胺使胆囊收缩减弱、Oddi括约肌张力增强,引起胆汁潴留有关 | |
| 腹部肿块 | 少数病人在左侧或右侧中上腹部可触及肿块 | 触及肿块可诱发高血压 |
| 泌尿系统 | 肾功能减退 | 病程长,病情重者可出现 |
| 血液系统 | 外周血白细胞和红细胞计数增多 | 血细胞重新分布 |
辅助检查
- 生化:血浆游离甲氧基肾上腺素或24小时尿甲氧基儿茶酚胺/香草扁桃酸显著升高;必要时克隆定抑制试验。
- 定位:肾上腺CT/MRI;功能显像:131I-MIBG或PET(如68Ga标记肽)。
| 检查类型 | 检查项目 | 诊断标准与临床意义 |
|---|---|---|
| 血、尿儿茶酚胺测定 | 血或尿去甲肾上腺素、肾上腺素 | 增高,常在正常高限2倍以上 |
| 尿儿茶酚胺代谢产物测定 | 香草基杏仁酸(VMA) 甲氧基肾上腺素(MN) 甲氧基去甲肾上腺素(NMN) | 均升高达正常值2倍以上 其中以MN、NMN的敏感度和特异度最高 |
| 胰高血糖素激发试验 | 药理试验 | 适用于:阵发性高血压发作间歇期可考虑做此试验 注意:持续性高血压病人,尿儿茶酚胺及代谢物明显增高,不必做药理试验 |
| 影像学检查 | 肾上腺B超、CT、MRI | 可用于肾上腺肿瘤的定位诊断 |
| ¹³¹I-间碘苄胍扫描 | 可显示分泌儿茶酚胺的肿瘤、转移灶、复发灶或肾上腺外肿瘤 |
诊断和鉴别诊断
与焦虑发作、甲亢、原发性高血压、甲状腺危象等鉴别。
治疗
- 根治:手术切除。
- 术前准备:先α受体阻滞(酚苄明/多沙唑嗪)7–14天+充分扩容,心率快再加β阻滞;禁单用β阻滞。
- 转移/复发:MIBG治疗、放化疗、靶向/放射核素治疗。
| 治疗阶段 | 药物类型 | 具体药物 | 用药要求与注意事项 |
|---|---|---|---|
| 术前准备和药物治疗 | α受体阻滞剂 | 酚苄明 (非选择性α受体阻滞剂) | 半衰期:36小时 副作用:直立性低血压、鼻黏膜充血 作用机制:阻滞α₁受体,不阻滞α₂受体 |
| 哌唑嗪 (α₁受体阻滞剂) | 半衰期:3-4小时 副作用:直立性低血压 作用机制:阻断α₁>>α₂(>100倍) | ||
| 用药时间:术前应用α受体阻滞剂不能少于2周,且用到手术前一天为止 | |||
| β受体阻滞剂 | 普萘洛尔 | 不作为常规,只能与α受体阻滞剂合用 作用机制:阻断β受体,心缩力降低,心肌耗氧量降低 | |
| 注意:不能在未使用α受体阻滞剂的情况下,单独应用β受体阻滞剂,否则由于阻断了β受体介导的舒血管效应而使血压升高,甚至发生肺水肿 | |||
| 用药标志 | 主张部分阻断α受体和β受体 标志:无明显直立性低血压,阵发性高血压发作次数减少,持续性高血压降至接近正常 | ||
| 术中血压管理 | 血压骤升 | 妥拉明静脉推注 | 继之以静滴或硝普钠静滴维持 |
| 心律失常 | 利多卡因 | 术中接触肿瘤时,可出现急骤血压升高和/或心律失常 | |
糖尿病
参考糖尿病和低血糖症
病因
- 1型:自身免疫性胰岛β细胞破坏,绝对胰岛素缺乏。
- 2型:胰岛素抵抗合并分泌相对不足,遗传+环境。
- 其他:胰腺疾病、内分泌病(库欣、原醛等)、药物(糖皮质激素等)、遗传缺陷;妊娠糖尿病。
发病机制
胰岛素分泌缺陷与/或胰岛素抵抗→糖/脂/蛋白代谢紊乱,慢性高血糖致微/大血管并发症与神经病变。
临床表现
多饮多尿多食消瘦或隐匿起病;复发感染、视物模糊;1型可发生酮症酸中毒。
辅助检查
- 诊断:任一满足(复测确认):空腹血糖≥7.0 mmol/L;或OGTT 2小时≥11.1;或随机血糖≥11.1合并典型症状;或HbA1c≥6.5%(标准化实验室)。
- 其他:C肽评估分泌;自身抗体(GAD等)提示1型;并发症基线评估(眼底、尿白蛋白、神经、心肾血脂)。
| 检查项目 | 方法与临床意义 | 备注 |
|---|---|---|
| 尿糖测定 | 尿糖阳性提示肾糖阈相关或血糖显著升高;作为糖尿病筛查的重要线索。 | 肾糖阈升高见于糖尿病肾病;肾糖阈降低可见于妊娠。尿糖为诊断糖尿病的辅助手段(非确诊指标)。 |
| 血糖测定 | 静脉血浆葡萄糖为诊断糖尿病的主要依据;血浆/血清血糖≈全血糖的约15%差异。 | 血糖是诊断糖尿病最重要的检查(静脉血浆葡萄糖);门诊测得升高须用静脉血确认。 |
| 口服葡萄糖耐量试验(OGTT) | 成人口服75 g无水葡萄糖,给予250–300 ml水,测定空腹及服糖后2小时静脉血浆葡萄糖。 | 当空腹血糖或随机血糖异常但未达到诊断标准时,须进行OGTT以明确诊断。 |
| 糖化血红蛋白(HbA1c) | 反映近8–12周平均血糖水平;HbA1c含量与血糖浓度正相关。 | 正常人HbA1c占红细胞总蛋白约3%–6%;红细胞寿命约120天。可用于长期血糖控制评估并辅助诊断。 |
| 糖化白蛋白(GA) | 反映近2–3周内平均血糖水平,与血糖浓度正相关。 | 正常值约11%–17%;GA半衰期约19天,可用于短期血糖控制评估或在影响HbA1c准确性的情况下替代监测。 |
| 重要提示 | 1) 诊断糖尿病以静脉血浆葡萄糖(空腹/OGTT/随机并结合临床)为准;2) 血糖处于高值但未达诊断时应行OGTT;3) HbA1c与GA可用于反映治疗后血糖控制情况。 | |
| 胰岛β细胞功能检查 — 胰岛素释放试验 | 口服75 g无水葡萄糖后,测血浆胰岛素30–60 min升高至峰值(峰值约为基础的5–10倍),3–4小时回落至基线。 | 可反映基础与葡萄糖刺激引导的胰岛素分泌能力;受血清中胰岛素抗体或外源性胰岛素干扰时结果需谨慎。 |
| C肽释放试验 | 方法同上,正常空腹基线值≥400 pmol/L(注:依据检验法略有差异),峰值为基线的5–6倍。 | 反映内源性胰岛素分泌(不受外源性胰岛素干扰);用于评估自身胰岛β细胞功能及鉴别胰岛素来源。 |
| 其他 | 静脉注射葡萄糖/胰岛素激发等试验可评估胰岛素分泌的一时相与二时相功能。 | 高糖刺激试验(胰高血糖素、C肽等)与胰岛素刺激试验可用于进一步明确胰岛素分泌储备与分泌动力学。 |
诊断和鉴别诊断
区分1型/2型/其他特殊类型;与应激性高血糖、药源性高血糖鉴别。
- 诊断标准
| 糖尿病诊断标准(静脉血浆葡萄糖) | |
|---|---|
| 诊断条件 | 糖尿病症状+随机血糖≥11.1mmol/L 或 空腹血糖≥7.0mmol/L 或 OGTT 2小时血糖≥11.1mmol/L 或 糖化血红蛋白≥6.5% |
| 重要提醒 | 若无"三多一少"的症状,需再测一次确认,诊断才能成立 注意:首次将"糖化血红蛋白≥6.5%"作为糖尿病的诊断标准写入教材 |
- 糖代谢状态分类
| 分类项目 | 正常血糖(NGR) | 空腹血糖受损(IFG) | 糖耐量减低(IGT) | 糖尿病(DM) |
|---|---|---|---|---|
| 空腹血糖 (mmol/L) | <6.1 | 6.1~<7.0 | <7.0 | ≥7.0 |
| OGTT 2小时血糖 (mmol/L) | <7.8 | <7.8 | 7.8~<11.1 | ≥11.1 |
| 注:1mmol/L×18=1mg/dl;国际糖尿病专家委员会建议的IFG限值为5.6~6.9mmol/L | ||||
药物
- 降糖药
| 药物种类 | 作用机制 | 常用药品 | 临床应用 | 不良反应 |
|---|---|---|---|---|
| 双胍类 | 抑制肝糖输出、改善外周胰岛素敏感性并轻度降低肠促胰岛素分解;不引起胰岛素分泌过度。 | 二甲双胍(metformin) | 一线用药:2型糖尿病首选,适用于超重/肥胖患者;可与其他药物合用以降低HbA1c。 | 胃肠道不良反应(腹泻、恶心);罕见:乳酸性酸中毒(肾功能不全、低灌注时风险↑)。 |
| 磺脲类 | 刺激胰岛β细胞胰岛素释放(关闭KATP通道)。 | 格列本脲、格列美脲、格列吡嗪 | 降糖效果强,适用于需口服降糖剂但自身胰岛功能仍有残余的2型糖尿病患者。 | 低血糖风险高(尤其老年人、肾功能不全);体重增加;偶见皮疹、消化道反应。 |
| 格列奈类(短效促泌剂) | 快速短效刺激胰岛素分泌,对餐后高血糖有效。 | 瑞格列奈、那格列奈 | 餐前用以控制餐后血糖;适合进食时间不固定者或需短时间加强胰岛素分泌者。 | 低血糖(短暂)、体重增加、胃肠不适。 |
| 噻唑烷二酮类(TZD) | 激动PPAR-γ,增加胰岛素敏感性,改善脂代谢。 | 吡格列酮、罗格列酮(多数地区慎用或限用) | 对胰岛素抵抗明显者有效;可与其他药物合并使用以降低HbA1c。 | 体重增加、液体潴留/充血性心力衰竭加重、骨折风险↑;部分与心血管风险争议。 |
| α-葡萄糖苷酶抑制剂 | 抑制肠道碳水化合物分解,延缓葡萄糖吸收,主要降低餐后血糖。 | 阿卡波糖、米格列醇 | 用于控制餐后高血糖,常与其他口服药合用;对空腹血糖作用有限。 | 腹胀、腹胀伴放气、腹泻;低血糖一般需与促泌剂合并时才发生。 |
| DPP‑4抑制剂 | 抑制DPP‑4酶,延长GLP‑1和GIP作用,增强胰岛素分泌并抑制胰高血糖素(葡萄糖依赖性)。 | 西格列汀、沙格列汀、利格列汀、阿格列汀 | 中等降糖效果,低低血糖风险,适合与其他药物合并或对低血糖敏感者。 | 总体耐受性好;少见上呼吸道感染、头痛、胰腺炎报道(罕见)。 |
| GLP‑1受体激动剂(注射) | 模拟肠促胰岛素GLP‑1:促胰岛素分泌、抑制胰高血糖素、延缓胃排空并促饱腹感,常伴体重下降。 | 艾塞那肽、利拉鲁肽、度拉糖肽、司美格鲁肽 | 适用于需减重或心血管高危患者:可降低体重并有心血管获益(部分制剂);用于需强效降糖且希望减重者。 | 恶心、呕吐、腹泻;罕见胰腺炎及甲状腺C细胞肿瘤的实验性关注(主要在动物研究)。 |
| SGLT2抑制剂 | 抑制肾小管近曲小管钠‑葡萄糖共转运体2,增加尿糖排泄,降低血糖并有利尿/降压作用。 | 达格列净、恩格列净、卡格列净 | 改善心肝肾结局(部分证据):适用于需降糖同时有心衰/慢性肾病或希望体重下降的患者。 | 尿路/生殖道真菌感染、低血压、脱水、酮症性酸中毒(罕见但严重),骨折/截肢风险提示(个别药物)。 |
- 胰岛素制剂
| 类别 | 制剂 | 皮下注射作用时间(小时) 起效 / 峰值 / 持续;注意事项 |
|---|---|---|
| 短效胰岛素 | 普通胰岛素(RI) | 起效:0.25~1;峰值:2~4;持续:5~8。RI为唯一可静脉注射的胰岛素,用于抢救DKA,控制餐后一过高血糖 |
| 半慢胰岛素锌混悬液 | 起效:1~2;峰值:4~6;持续:10~16。 | |
| 中效胰岛素 | 低精蛋白胰岛素 | 起效:2.5~3;峰值:5~7;持续:13~16。主要提供基础胰岛素,控制两餐后高血糖 |
| 慢胰岛素锌混悬液 | 作用时间资料不详(常用于延长基础作用)。 | |
| 长效胰岛素 | 精蛋白锌胰岛素注射液 | 起效:3~4;峰值:8~10;持续:长达20小时。长效胰岛素无明显作用高峰,主要提供基础胰岛素 |
| 特慢胰岛素锌混悬液 | 作用时间资料不详(用于更持久的基础供给)。 | |
| 预混胰岛素 | 30R (中效/短效 70/30) | 起效:0.5;峰值:2~12;持续:14~24。 |
| 50R (中效/短效 50/50) | 起效:0.5;峰值:2~3;持续:10~24。 |
- 胰岛素类似物
| 类别 | 制剂 | 皮下注射作用时间(小时) / 注意事项 |
|---|---|---|
| 速效胰岛素类似物 | 门冬胰岛素(Asp) | 起效0.25 / 峰值1–2 / 持续4–6;可于进餐前注射,主要用于控制餐后血糖峰值。 |
| 赖脯胰岛素(Lispro) | 起效0.25 / 峰值1–1.5 / 持续4–5;进餐前注射,起效快,需注意餐后低血糖风险与用量/时机相关。 | |
| 短效/常规胰岛素 | 常规胰岛素(Regular) | 起效2–3 / 可见峰值 / 持续可达6–8(皮下)或按静脉给药更快;用于餐前或静脉给药场合,计时注射与进餐需配合。 |
| 长效胰岛素类似物 | 甘精胰岛素(Glargine) | 起效1–2 / 无明显峰值 / 持续约24;提供平稳基础胰岛素,低血糖风险较传统制剂低,适合基础替代。 |
| 地特胰岛素(Detemir) | 起效3–4 / 峰值3–14(个体差) / 持续可达24;剂量依赖性持续时间,利于平稳基础控制。 | |
| 德谷胰岛素(Degludec) | 起效1 / 无明显峰值 / 持续可达42;超长效,基础水平非常稳定,昼夜波动小。 | |
| 预混胰岛素类似物 | 预混门冬胰岛素 30(30/70) | 起效0.25 / 峰值1–4 / 持续14–24;使用方便但比例固定,仅适用于血糖波动小且易控制者。 |
| 预混门冬胰岛素 50(50/50) | 起效0.25 / 峰值1–4 / 持续14–24;餐后降糖效应较强,需按餐量/血糖个体化调整。 | |
| 预混赖脯胰岛素 25(25/75) | 起效0.25 / 峰值0.5–1 / 持续16–24;兼顾餐时与基础,固定比例限制灵活性。 | |
| 预混赖脯胰岛素 50(50/50) | 起效0.25 / 峰值0.5–1 / 持续16–24;餐时作用更显著,需监测餐后血糖并调整用量。 |
治疗
-
综合管理:医学营养+运动+教育+血糖监测。
-
降糖药:二甲双胍为2型一线首选(无禁忌);成人动脉粥样硬化性心血管疾病(ASCVD)优选GLP-1受体激动剂或SGLT2抑制剂;心衰/慢性肾功能不全(CKD)优选SGLT2抑制剂;低血糖高风险者避免磺脲/过量胰岛素。
-
胰岛素:1型必需;2型血糖高或急性并发症、围手术、妊娠、感染失代偿时启用。
-
目标:个体化HbA1c一般<7%;血压、血脂、肾心保护并重;并发症定期筛查。
| 指标 | 目标值 | 简明说明 |
|---|---|---|
| 空腹血糖 | 4.4–7.0 mmol/L | 糖代谢控制的常用目标范围。 |
| HbA1c | <7.0% | 糖化血红蛋白长期血糖控制目标(一般成人)。 |
| LDL‑C | <2.6 mmol/L(未合并冠心病) | 一级预防人群目标;合并冠心病者见下。 |
| TG(甘油三酯) | <1.7 mmol/L | 提示高甘油三酯需评估胰岛素抵抗与心血管风险。 |
| 总胆固醇 | <4.5 mmol/L | 总体血脂控制目标之一。 |
| 非空腹血糖 | <10.0 mmol/L | 餐后或随机血糖的常用阈值。 |
| 血压 | <130/80 mmHg | 糖尿病或心血管危险人群推荐目标。 |
| LDL‑C(合并冠心病) | <1.8 mmol/L | 二级预防或既往冠心病患者更严格的LDL‑C目标。 |
| HDL‑C | >1.0 / 1.3 mmol/L(男 / 女) | 高密度脂蛋白,性别分界不同,越高越好。 |
| 体重指数(BMI) | <24 kg/m² | 常用的体重控制目标,依据人群可调整。 |
糖尿病酮症酸中毒(DKA)
病因
- 诱因:感染(最常见)(肺炎、尿路感染、皮肤软组织感染)、胰岛素中断/不足、初发1型糖尿病、应激(手术、创伤、心肌梗死、脑卒中、胰腺炎)、药物(糖皮质激素、噻嗪类、拟交感药、非依赖性抗精神病药)等。
- 人群:以1型糖尿病多见,亦见于胰岛素相对不足的2型糖尿病。
发病机制
- 胰岛素绝对/相对不足+升糖激素(胰高糖素、儿茶酚胺、皮质醇、生长激素)升高→糖异生与糖原分解↑→高血糖与渗透性利尿→严重缺水与电解质紊乱。
- 脂解增强→游离脂肪酸进入肝脏β氧化→酮体产生(乙酰乙酸、β-羟丁酸)→高阴离子间隙代谢性酸中毒。
- 钾:总量显著减少,初诊血钾可“正常/偏高”(移位性高钾)。
临床表现
- 起病较急。多尿、多饮、体重下降、乏力;脱水体征明显。
- 酸中毒表现:Kussmaul深大呼吸、呼气烂苹果味、恶心呕吐、腹痛。
- 神经系统:嗜睡、意识障碍(进展提示重症/脑水肿)。
- 循环:心动过速、低血压,严重者休克。
- 儿童更易发生脑水肿(最危险并发症)。
辅助检查
- 血糖通常≥13.9 mmol/L(但若胰岛素部分使用可不很高)。
- 酸碱/电解质:动脉/静脉pH<7.30,HCO3-<18 mmol/L,阴离子间隙(AG)>10–12 mmol/L;Na+因高血糖致稀释性低钠,K+总量低但血钾初期可正常/偏高。
- 酮体:血β-羟丁酸显著升高;尿酮(检乙酰乙酸)可低估病情。
- 渗透压:有效渗透压=2×Na+(mmol/L)+血糖(mmol/L),中度升高。
- 诱因评估:血象、CRP/降钙素原、胸片、尿常规/培养、心肌酶、淀粉酶/脂肪酶等。
诊断和鉴别诊断
- 诊断要点:高血糖+高阴离子间隙代谢性酸中毒+酮症。
- 重症分级(参考):轻度pH 7.25–7.30、HCO3- 15–18;中度pH 7.00–7.24、HCO3- 10–<15;重度pH<7.00、HCO3-<10。
- 鉴别:高渗高血糖综合征(HHS,严重高渗/轻或无酮症)、乳酸性酸中毒、饥饿性酮症、酒精性酮症、毒物(甲醇/乙二醇/水杨酸盐)等。
| 项目 | 酮症酸中毒(DKA) | 高渗高血糖综合征(HHS) | 备考要点 |
|---|---|---|---|
| 典型人群 | 1型糖尿病、青少年/妊娠 | 老年2型糖尿病 | 感染为最常见诱因;HHS常伴摄水不足、基础病多。 |
| 起病 | 较急 | 隐匿、进展慢 | HHS病程更长,来院时更重脱水。 |
| 血糖(mmol/L) | 通常≥13.9 | ≥33.3 | HHS高于DKA。 |
| 有效渗透压(mOsm/kg) | 中度升高 | ≥320 | 公式:2×Na+ + 血糖(mmol/L)。 |
| 酸碱/AG | 代谢性酸中毒、AG增高 | pH>7.30、HCO3-≥18,AG正常或轻增 | DKA以β-羟丁酸为主,尿酮可低估。 |
| 酮体 | 明显升高 | 无或轻度 | 血酮较尿酮更可靠。 |
| 脱水量 | 约6–8 L(成人) | 约8–10 L(成人) | HHS缺水更多。 |
| 神经系统 | 轻–中度,重者脑水肿 | 更突出:谵妄、癫痫、局灶体征 | 儿童DKA脑水肿为最严重并发症。 |
| 死亡率 | 低于HHS | 更高 | HHS为高血糖危象中病死率更高。 |
| 补液 | 0.9%NaCl起始15–20 mL/kg·首小时;达13.9 mmol/L加糖液 | 同DKA但更强调渐进降渗 | 依据“校正Na+”在0.9%与0.45%间选择;渗透压下降≤3 mOsm/kg·h。 |
| 胰岛素 | 0.1 U/kg·h静滴,血糖降至13.9后改0.05 | 0.05 U/kg·h起始可行 | 目标降糖2.8–4.4 mmol/L·h,避免过快。 |
| 钾 | K+<3.3先补钾后胰岛素;3.3–5.2随液补钾 | 同DKA | 总钾缺失显著,心电监护、保证尿量。 |
| 碳酸氢钠 | 仅pH<6.9时考虑 | 通常不需 | 常规应用无益且有风险。 |
| 抗凝 | 个体化 | 倾向预防性抗凝 | HHS高凝、血栓风险更高。 |
| 转皮下胰岛素 | AG关闭、HCO3-≥18、pH≥7.3、能进食 | 同DKA | 皮下与静滴重叠1–2小时。 |
治疗
- 原则:补液(首要)→胰岛素→补钾→纠正酸碱与电解质→处理诱因,严密监测。
- 补液:
- 起始用0.9%氯化钠,前1小时15–20 mL/kg(约1–1.5 L)。
- 之后按“校正Na+”(校正Na+=测得Na+ + 1.6 mmol/L×每升高5.6 mmol/L血糖)与血流动力学决定用0.9%或0.45% NaCl;总缺水约6–8 L(成人),4–6小时补回一半。
- 血糖降至约13.9 mmol/L时加入5%葡萄糖(或变更为含糖液)以防低血糖并持续清除酮体。
- 胰岛素:短效胰岛素静脉持续泵入0.1 U/kg·h(一般可不推注)。目标血糖下降速率约2.8–4.4 mmol/L·h;达13.9 mmol/L后改0.05 U/kg·h并配合含糖液,直至酮症/AG关闭。
- 钾:开始时若K+<3.3 mmol/L,先补钾,暂缓胰岛素;K+ 3.3–5.2 mmol/L,每升补液加20–30 mmol KCl维持4–5 mmol/L;K+>5.2 mmol/L暂不补,密切监测。需有尿(≥0.5 mL/kg·h)且心电监护。
- 碳酸氢钠:仅pH<6.9时考虑小剂量静滴;常规不推荐。
- 磷:重度低磷或呼吸肌/心肌无力、溶血时补(可用K2HPO4替代部分KCl)。
- 诱因治疗:经验性抗菌后根据培养调整;停用诱发药物。
- 转换皮下胰岛素:患者清醒可进食、AG关闭、HCO3-≥18、pH≥7.3后,与静滴重叠1–2小时再停泵,避免反跳高血糖。
- 监测:每1–2小时血糖、生命体征;每2–4小时电解质、HCO3-/血气、渗透压、尿量;持续心电监护。
- 儿童要点:避免过快降渗透压,警惕脑水肿预警(头痛加重、意识恶化、心动过缓/血压升高、瞳孔变化、癫痫),一旦发生立即甘露醇0.5–1.0 g/kg静推或3%高渗盐水5–10 mL/kg。
高渗高血糖综合征(HHS)
病因
- 多见于老年2型糖尿病,诱因与DKA类似:感染(最常见)、胰岛素/口服降糖药中断、应激事件、利尿剂/糖皮质激素等。
- 口渴感下降、合并疾病(卒中、痴呆、行动不便)常使摄水不足,促进高渗。
发病机制
- 胰岛素虽不足以抑制肝糖输出与胰高糖素效应,导致显著高血糖;但尚能抑制脂解与酮体生成→显著高渗、极重脱水、酮症轻微或缺如。
- 渗透性利尿致水钠大量丢失;血液黏稠→高凝与血栓风险。
临床表现
- 起病隐匿、进展数日。极度口渴、多尿直至少尿/无尿,严重脱水(皮肤干燥、眼球下陷、低血压、休克)。
- 神经系统症状更突出:意识障碍、谵妄、癫痫、局灶神经体征。
- 常合并基础心脑血管疾病或感染体征。
辅助检查
- 血糖常≥33.3 mmol/L。
- 有效血浆渗透压≥320 mOsm/kg(计算:2×Na+ + 血糖,单位mmol/L)。
- 酸碱:pH>7.30,HCO3-≥18 mmol/L;酮体阴性或轻度阳性;AG多正常或轻度增高。
- 钾、钠:总缺失多;Na+多升高(高渗性高钠或校正后升高);K+总量低但可正常/偏高。
- 肾功能、乳酸、心肌损伤标志物可异常;炎症指标升高提示感染。
诊断和鉴别诊断
- 诊断要点:极重高血糖+高渗+严重脱水,酸中毒与酮症不显著。
- 鉴别:DKA、乳酸性酸中毒、尿毒症合并高渗、抗利尿激素异常、渗透性物质摄入(甘露醇)等。
治疗
- 原则:积极补液(优先级更高、量更大)→胰岛素→电解质管理→处理诱因;缓慢降低渗透压避免脑水肿。
- 补液:
- 初始0.9% NaCl,前1小时15–20 mL/kg;总缺水常达8–10 L(成人)。
- 根据“校正Na+”与血流动力学在0.9%与0.45% NaCl间调整;目标有效渗透压下降速率约≤3 mOsm/kg·h。
- 血糖降至约16.7–13.9 mmol/L加入5%葡萄糖,改慢速降糖以逐步降渗。
- 胰岛素:起始剂量可略低于DKA,如0.05 U/kg·h静脉泵入;血糖下降目标2.8–4.4 mmol/L·h。
- 钾/钠管理同DKA,特别注意高渗性高钠的渐进纠正。
- 抗凝:高凝风险高者考虑预防性抗凝(如低分子肝素),个体化评估出血风险。
- 诱因治疗同DKA。
- 监测与ICU指征:意识障碍、休克、严重电解质紊乱/肾衰、合并心脑血管事件者宜ICU。
低血糖症
病因
- 糖尿病治疗相关:胰岛素、磺脲类、进食不足/运动过量/肾功能不全。
- 非糖尿病人群:胰岛素瘤、非胰岛β细胞肿瘤(IGF-2分泌)、严重肝病、败血症、肾上腺或垂体功能不全、酒精相关、药物(奎宁等)。
发病机制
- 血糖低于脑供能阈值→交感兴奋(心悸出汗颤抖)与中枢神经糖缺乏(头晕、行为异常、抽搐、昏迷)。
- 一般引起低血糖症状的血浆葡萄糖阈值为2.8~3.9mmo/L,然而,对于反复发作的低血糖患者,这一阈值则会更低。
临床表现
Whipple三联征:低血糖症状+证实血糖低(<2.8mmolL)+补糖后缓解;重症可意识障碍/惊厥。
| 症状类型 | 具体表现 | 发生机制 |
|---|---|---|
| 自主神经症状 | 震颤、心悸、焦虑、出汗、饥饿和感觉异常 | 主要由交感神经激活造成,而非肾上腺髓质激活所致 |
| 神经低血糖症状 | 认知损害、行为改变、精神运动异常、癫痫样发作和昏迷 | 脑组织葡萄糖供应不足 |
| 常见体征 | 面色苍白和出汗 | 低血糖的常见体征 |
| 发作特点 | 低血糖呈发作性 | 发作时间及频率随病因不同而异 |
辅助检查
- 发作时采血:血糖、胰岛素、C肽、胰高血糖素、β-羟丁酸;磺脲/格列奈筛查。
- 72小时禁食试验:诊断空腹低血糖与胰岛素瘤。
- 影像:内分泌肿瘤定位(超声/CT/MRI/内镜超声)。
诊断和鉴别诊断
- 区分药源性与内源性高胰岛素血症(药源性C肽低;胰岛素瘤C肽高且磺脲阴性);鉴别癫痫、短暂性脑缺血、惊恐发作。
治疗
- 急性:清醒者口服15–20 g快速糖(“15–15原则”);重症静脉50%葡萄糖推注后10%持续;无静脉通路肌注/皮下注射胰高血糖素。
- 病因治疗:调整降糖方案;胰岛素瘤手术切除;肾上腺不全补充糖皮质激素;饮食分配治疗反应性低血糖。